Carbonatos e Bicarbonatos Alcalinos
INTRODUÇÃO:
Carbonatos e bicarbonatos são excelentes reagentes para se ter a mão, tanto para o químico "profissional" como o amador. O bicarbonato pode algumas vezes ser encontrado também com o nome de "carbonato ácido" ou de "hidrógeno-carbonato"(O prefixo BI na frente de CARBONATO não significa "dois", mas sim (mono)hidrógeno, como você deve saber do seu livro de química)...
Em várias aplicações podem substituir com vantagens os respectivos hidróxidos, como por exemplo na preparação de outros sais inorgânicos e mesmo orgânicos. Além de servirem também para precipitar outros íons contidos em soluções, como por exemplo Cu+2(aq), Mn+2(aq), Fe+2(aq), Pb+2(aq) e outros, dando carbonatos , carbonatos básicos e talvez mesmo bicarbonatos praticamente insolúveis.
Soluções fracas de bicarbonato de sódio , por exemplo, podem ser úteis também como uma precaução contra acidentes com ácidos: basta fazer uma solução de NaHCO3 , e deixá-la intencionalmente em algum local de fácil acesso, perto de onde você realiza algum experimento com ácidos. Caso ocorra de cair algum tipo de ácido na sua pele, você imediatamente pode lavar com largas quantidades de água corrente e então usar um pouco da sua solução de bicarbonato para neutralizar a acidez residual e então lavar com mais água corente para remover tudo.
Carbonato e bicarbonato de sódio são , no presente momento, bastante fáceis de se adquirir no comércio comum , e com boa pureza (especialmente o bicarbonato de sódio, que é destinado geralmente a fins alimentícios). Carbonato de sódio é também muito comum, sendo encontrado facilmente como "barrilha"(nome comercial) como "aumentador de pH" para água de piscinas e como "aditivo" em certas formulações para produtos de limpeza, além de ser também muito usado na indústria de fabricação de vidros..Outras aplicações comuns podem ser encontradas , por exemplo, em [4].
Por isso as sínteses de (bi)carbonato de sódio aqui podem parecer "inúteis" embora eu considere elas apenas como "diversão". Mas os mesmos sais de potássio podem te dar bem trabalho para encontrar. Mas em todo caso, seria de bom alvitre que o químico amador tomasse consciência,uma vez que talvez algum dia esses sais de sódio (carbonato e bicarbonato), que hoje são encontrados facilmente, possam se tornar difíceis de se encontrar no mercado aberto, devido a certos problemas (como por exemplo os mencionados em [1]). Isso pode parecer ridículo, contudo algumas vezes acontece com certos químicos "disponíveis" e sem nem mesmo prévio aviso.
Outros (bi)carbonatos como o de lítio (que é o mais comum depois dos (bi)carbonatos de sódio e potássio) são extremamente difíceis para o químico amador encontrar. Eu mesmo já tentei procurar o Li2CO3 num FORNECEDOR DE PRODUTOS QUÍMICOS, mas sem sucesso!
Vários métodos tem sido abordados na web para produção amadora de carbonato/hidróxido de potássio e o principal deles é a extração de cinzas de plantas.. Um processo típico é apresentado em [4]. Tal processo não será descrito aqui, pelo menos por hora.. É muito trabalhoso , dando um produto acinzentado impuro , baixos rendimentos e rendimentos ainda menores vão ser obtidas se você tentar purificar por recristalização. Além disso, não seria muito "original", justamente porque muitos fizeram.. Por isso , vou tentar apresentar (mais tarde) métodos menos trabalhosos para fazer o nosso (bi)carbonato de potássio, baseados na fonte principal de potássio (cloreto de potássio) que é barato e fácil de achar.
E tome cuidado com carbonatos alcalinos, pois como eles possuem um caráter muito mais básico que os respectivos bicarbonatos, o caráter corrosivo deles é bem mais acentuado, próximo ao dos respectivos hidróxidos, especialmente para a pele/olhos , além de suas soluções (especialmente à quente) poderem danificar facilmente objetos feitos de certos metais, como alumínio por exemplo. Além disso, tome cuidado ao manipular todas essas substâncias quando em pó, pois podem facilmente "voar" e se difundir pelo o ar adjacente, fazendo com que seu trato respiratório fique exposto a eles e sua ação corrosiva, que é tanto pior quanto mais básico for o composto. Portanto tente usar máscara contra pós para não ficar exposto.
Abaixo uma pequena tabela com nomes, pesos moleculares de algumas das substâncias mencionadas aqui ,e algumas outras informações adicionais que podem ser de alguma serventia:
| Substância , Nome "Popular", Fórmula e Estado Físico Em Que é Comumente Encontrada | Peso Molecular Aproximado | Informações Adicionais |
| Cloreto de Amônio (NH4Cl(s)) |
53,5 | Informação de Segurança (Inglês),(Português), Obtenção |
| Cloreto de Sódio ("Sal de Cozinha" - NaCl(s)) |
58,5 | Informação de Segurança (Inglês) |
| Cloreto de Potássio (KCl(s)) |
74,6 | A melhor fonte para o amador é a encontrada como "adubo" e disponível em diversas lojas de insumos agrícolas ou mesmo em algumas casas de ração..Pelo que vi existem alguns tipos desse adubo , que diferem apenas na granulometria e na 'marca'..Pode vir na forma de pó fino ou de "pedrinhas"; ambas de coloração rosada ou mesmo avermelhada (essa coloração é devida a impurezas na hora da extração na mina (especialmente a Carnalita) ou adicionadas na fase de processamento do adubo e não afetam tanto no final, a não ser pelo fato de entupirem facilmente os poros de praticamente qualquer filtro, retardando a filtração).. Tente escolher a forma em pó que é purificada mais facilmente. É um excelente adubo visto que , logicamente, possui um alto teor de potássio que é essencial (60 a 62% de K2O , sendo que portanto o NPK desse fertilizante seja algo em torno de 00-00-60 , 00-00-62 , etc). Informação de Segurança (Inglês) ; Obtenção |
| Hidrogenocarbonato de Amônio ("Bicarbonato de amônio" -NH4HCO3(s)) |
79 | Informação de Segurança (Inglês),(Português) |
| Amônia (anidra) (NH3(g)) |
17 | Informação de Segurança (Inglês) , (Português) |
| Hidróxido de Amônio ("Amoníaco" - NH4OH(aq)) |
35 | Informação de Segurança (Inglês) , (Português) |
| Anidrido Carbônico ("Dióxido de Carbono" "Gás Carbônico",etc CO2(g)) |
44 | Informação de Segurança (Inglês),(Português) |
| Hidrogenocarbonato de Sódio ("Bicarbonato de Sódio" - NaHCO3(s)) |
84 | Informação de Segurança (Inglês) |
| Carbonato de Sódio ("Barrilha" - Na2CO3(s)) |
106 | Facilmente encontrado em lojas de químicos para piscinas ou mesmo em outros locais e com boa pureza. - Informação de Segurança para o sal anidro e o monohidratado (Inglês) |
| Hidrogenocarbonato de Potássio ("Bicarbonato de potássio" - KHCO3(s)) |
100,1 | Informação de Segurança (Inglês) |
| Carbonato de Potássio (K2CO3(s)) |
138,2 | Pode ser encontrado em algumas lojas de produtos químicos , Informação de Segurança (Inglês) |
Como esses compostos (notadamente o carbonato de sódio) são essenciais tanto na indústria em geral, quanto em outros setores, eles possuem uma história até que interessante..
Durante a segunda metade do século XVIII, a maior parte da Europa estava em plena revolução industrial e a relativamente jovem indústria química, obviamente, era um dos motores que impulsionavam essa revolução. Por mais de um século os carbonatos foram uma das classes de químicos mais requisitados eram justamente os carbonatos alcalinos (especialmente o de sódio), que eram vitais na indústria do vidro, de sabão e de muitas outras (e até hoje continua sendo bastante importante). O carbonato de potássio era extraído especialmente das cinzas de plantas que cresciam em terras mais afastadas do litoral , enquanto que o carbonato de sódio era produzido do mesmo modo, mas preferencialmente de plantas mais proximas do litoral (por motivos óbvios.. A quantidade de sódio em áreas próximas ao litoral é muito maior , devido a sutil ação do mar). O fato, meus amigos, é que tanto essa atividade, quanto a aquisição de lenha/carvão vegetal para "aquecer" a nascente indústria requeria a derrubada de LARGAS áreas de florestas.. Isso causou um desflorestamento massivo na Europa. Assim, com o crescente consumo, cada vez mais a Europa se viu obrigada a importar os carbonatos dos EUA, que possuiam (e ainda possuem) vastas minas de minério de trona, de onde os tais carbonatos podem ser facilmente extraídos.
O alto custo associado a alta demanda, logo se tornou um problema, e foi pensando nisso que a academia francesa de ciências da época ofereceu em 1775 uma grande recompensa para quem inventasse um método para converter , economicamente, o sal marinho (NaCl) em carbonato. Assim, em 1791, Nicolas LeBlanc, patenteou um processo relativamente simples e que levou o seu nome, no qual se usava materiais relativamente baratos: NaCl, ácido sulfúrico, calcário (CaCO3) e carvão.
Nesse processo, numa primeira etapa, o cloreto de sódio era convertido em bissulfato de sódio e então em sulfato de sódio, com co-produção do extremamente útil ácido clorídrico (a primeira reação ocorre com facilidade, mas a segunda é muito mais dificil e só ocorre com altas temperaturas):
{1ª reação} NaCl + H2SO4  NaHSO4 + HCl(g)
NaHSO4 + HCl(g)
{2ª reação} NaHSO4 + NaCl  Na2SO4 + HCl(g)
Na2SO4 + HCl(g)
Juntando tudo, temos a reação global:
2 NaCl + H2SO4  Na2SO4 + 2 HCl(g)
Na2SO4 + 2 HCl(g)
Então, o sulfato de sódio produzido era misturado com o carvão e com o calcário , mediante forte aquecimento, conforme a equação:
Na2SO4 + CaCO3 + 2 C ![]() CaS + 2 CO2 + Na2CO3
CaS + 2 CO2 + Na2CO3
Apartir daí, bastava lixiviar (extrair) o carbonato resultante usando água quente, filtrar e recristalizar; devido ao fato de que os outros materiais eram praticamente insolúveis (carvão não reagido, CaS, CaCO3, etc) poderiam ser separadas facilmente. Se houvesse qualquer sulfato de sódio presente, poderia ser removido via recristalização.
O mais engraçado (na realidade triste) foi que esse método atendeu ao que foi exigido e portanto, era para ter ELE recebido o prêmio. Contudo, não foi o que ocorreu. O cara gastou um tempo consierável de sua vida na pesquisa (> 15 anos), uma grana violenta tanto no desenvolvimento quanto na construção POR ELE de uma planta para produção do carbonato de sódio usando o método DELE (a tal planta conseguia produzir até 320 toneladas do material por ano). O motivo pelo qual ele não ganhou o prêmio foi por pura falta de sorte..Após dois anos de operação de sua planta o governo revolucionário francês que se fortalecia confiscou sua fábrica e recusou a pagar a sua recompensa.. Depois disso, quando a "poeira baixou", Napoleão, em 1802, devolveu a ele a sua fábrica, mas não pagou a recompensa. Em tais condições e totalmente falido, ele não teve como manter a fábrica. Resultado: Ele se suicidou em 1806.
Bom, após isso veio o método descoberto por Solvay, que triste e ironicamente, num futuro próximo, também iria mandar o método desenvolvido LeBlanc para o caixão.. E esse método, de longe mais barato e prático, usando basicamente apenas CaCO3 (fonte efetiva de CO2 e CaO no processo), NH3 e NaCl será o descrito mais abaixo.
EXPERIMENTAL:
BICARBONATO DE SÓDIO (NaHCO3)
Dissolvi 60g de NaCl em 180mL de água na temperatura ambiente e com agitação da mistura (demorou um pouco e ainda assim não dissolveu tudo),e filtrei. Peguei outro recipiente e fui adicionando 80g de NH4HCO3 em 170mL de água.. A solução ficou BEM fria e borbulhando um pouco devido ao excesso de CO2. Após 2 minutos de constante agitação da mistura eu filtrei essa solução e adicionei ela ainda fria a solução filtrada de NaCl. Em curto espaço de tempo foi precipitando um largo volume e cristais brancos.. Então após um minuto eu filtrei a solução.
Não lavei os cristais nem nada.. (Não há a real necessidade para mim de realizar essa síntese, visto que eu tenho um bocado de NaHCO3 comercial guardado). A quantidade obtida (impura) foi aprox. 55g que corresponde a um rendimento de aproximadamente 65-66% do teórico. Se você lavar bem o produto com água gelada , você pode obter um produto com pureza até razoável, Já que, como eu disse anteriormente, essa é uma preparação antiga de laboratório , entretanto , esse método para produzir bicarbonato de sódio diretamente não é usado no método Solvay industrial. Ao contrário, é produzido primeiro o carbonato, que pode ser então "carbonatado", se desejável, com excesso de CO2, para dar o bicarbonato em forma mais pura, que é então lavado e separado.
(Veja "discussão dos resultados e propriedades" para mais detalhes).
Solução de CARBONATO DE SÓDIO (Na2CO3(aq))
Eu já realizei esse processo algumas vezes quando precisava de carbonato mas não dispunha nos momentos que eu necessitava, e posso dizer que funciona muito bem (especialmente para preparar carbonatos e carbonatos básicos insolúveis). Creio que na maior parte das vezes você pode usar soluções de carbonato de sódio ao invés do sal em estado sólido, logo usando estequiometria pura e simples , basta você calcular a quantidade de bicarbonato de sódio necessária para preparar uma quantidade X de carbonato de sódio, usando uma quantidade Y de água fervente para ter uma solução com concentração Z de carbonato de sódio (se quer fazer uma solução com concentração soluto/solvente bem definida leve em consideração também a quantidade K de água produzida na reação abaixo). Para o cálculo estequiométrico, basta usar essa simples equação:
2 NaHCO3(aq)  Na2CO3(aq) + CO2(g) + H2O(l)
Na2CO3(aq) + CO2(g) + H2O(l)
Curiosamente a maioria das pessoas que eu vejo em alguns fóruns sempre recomendam fazer isso (pirolisar) o bicarbonato sólido (não decompor na água (hidrolisar o NaHCO3)). A única possível vantagem que eu posso ver nisso seria a não necessidade de recristalizar os cristais ou remover a água: basta esquentar e pegar os cristais. Contudo outros problemas mais graves podem surgir, como por exemplo, a pureza do carbonato obtido , que pode não ser tão alta se você não esquentar bem e por bons períodos de tempo, camadas finas de bicarbonato. Eu contudo , ainda prefiro o método de decomposição na água. A água suficientemente quente força essa reação.
Por quê você acha que bicarbonato de sódio é adicionado a bolos e pães como "fermento químico"? Porque decompõe facilmente na massa úmida, para dar carbonato e CO2 e esse ultimo composto dá a agradável porosidade e leveza à massa.
Eu usualmente ponho a quantidade necessária de bicarbonato de sódio num copo de plástico grande , fervo água separadamente e jogo a água fervente aos poucos, muito lentamente, dentro do copo com o bicarbonato. Você verá que vai dar bastante espuma (por isso o uso de um copo grande, para evitar transbordos da solução). Esse é o CO2 sendo gerado. Eu uso de ferver agua separadamente porque minhas panelas são quase todas de alumínio. Se eu pusesse o bicarbonato na panela junto com a água, o carbonato formado atacaria o alumínio, causando corrosão e ao mesmo tempo impurificando o produto formado. Talvez alguém ainda possa usar uma panela de aço , embora eu ainda assim não recomende.
Como eu não necessito fazer carbonato de sódio em pó (tenho ainda 4 quilos de barrilha 98% que eu havia comprado numa loja de materiais de construção, e posso encontrar mais com facilidade se eu quiser), nunca tentei isolar o carbonato da solução, embora se alguem quisesse tentar eu recomendaria usar uma panela de aço inox (NUNCA ALUMÍNIO!) com a água fervente e o bicarbonato sendo adicionado aos poucos , e então evaporar MUITO CUIDADOSAMENTE a água até a secura.. Esse procedimento pode parecer simples, mas vai dar trabalho e riscos para quem quiser tentar porque *em geral* quando se ferve quase até a secura , os sais vão precipitando e formando uma espécie de "pasta" que atrapalha a subida natural das bolhas da ebulição do líquido residual que por isso se tornam-se violentas e "espirram" o material para todo canto, inclusive na cara de quem estiver perto.. E lembrando mais uma vez, carbonatos são em geral bem mais corrosivos que os respectivos bicarbonatos, logo, não seria bom uma solução fervente e saturada caindo na sua pele e olhos (por isso seria ÓTIMO usar uma mascara e óculos)..A saída então seria uma evaporação bem lenta: na hora que o líquido começar a "espirrar" o fogo deveria ser desligado e então encontrado outro modo de aquecimento de tal modo que o líquido não fervesse mais, mas apenas ficasse morno e evaporando..Após todo o líquido evaporado, então pode aquecer mais um pouco no fogo baixo, para retirar os últimos traços de umidade. Recristalizações do material também podem apresentar dificuldades, devido ao fato de que a alta alcalinidade do material pode causar problemas na hora de filtrar os cristais da solução residual: se você usar um filtro de papel comum (como por exemplo um filtro de papel descartável de coar café) ou mesmo de algodão , você corre o risco da solução "furar" o filtro devido ao ataque alcalino à celulose. Logo usar mais de um filtro pode ser necessário.
DISCUSSÃO DOS RESULTADOS E PROPRIEDADES:
Essa síntese de NaHCO3 foi uma versão ligeiramente "modificada" do que eu encontrei em [2] e em [3]. Modificada propositalmente para não se usar hidróxido de amônio concentrado , gerador kipp para produzir o CO2 , colunas vigreux para absorção, e várias outras parafernálias e químicos de laboratório que poucos tem acesso. Eu usei simplesmente bicarbonato de amônio (NH4HCO3) e que substitui com vantagens tanto a amônia quanto o CO2 necessários, que dispensa vidrarias exóticas e que ainda é encontrado facilmente em lojas onde é vendido materiais para confeitarias/padarias ou mesmo em alguns supermercados, como foi o meu caso. Outro químico necessário é o cloreto de sódio, NaCl (sal de cozinha) , que COM TODA CERTEZA você deve conhecer e que é ainda mais fácil de adquirir.
E de certa forma , todos esses procedimentos tem uma conecção em comum: são uma espécie de "Método Solvay" em pequena escala. Vale a pena conferir.(veja a sessão seguinte para mais detalhes).
Observações sobre o processo Solvay :

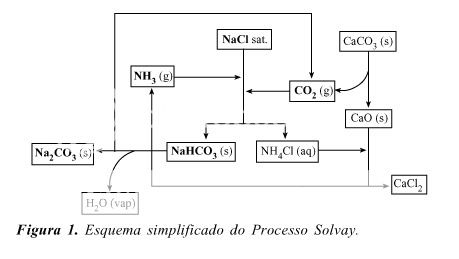

Acima está uma imagem que ilustra bem o processo em escala industrial (essa imagem foi extraída de um excelente estudo sobre o processo em escala "didática", divulgado na Scielo [2]).
O Processo Solvay pode até ter outra serventia no mundo amador: alternativa simples e barata para produção de cloreto de amônio (que sobra dissolvida na solução junto com outros sais residuais). Mais discussão sobre a possível idéia de como isolar esse interessante sal da solução AQUI.
O princípio do processo Solvay é extremamente simples: Como vários outros processos industriais para obtenção de certos produtos químicos, ele também se baseia unicamente na diferença de solubilidade entre sais conforme a temperatura. E como na indústria o objetivo lógico é maior economia e eficiência , se torna imperioso recuperar e reciclar ao máximo todos os produtos. E esse último detalhe, finalmente alcançado após árduo trabalho do inventor desse processo, que tornou o método rentável. Contudo, o processo ainda não é economicamente competitivo e portanto não é usado em muitos países onde o minério de trona (Na2CO3*NaHCO3*2 H2O - sesquicarbonato de sódio dihidratado) ocorre em largas quantidades, como por exemplo , nos EUA e na áfrica do sul. Em outros países , como o Brasil por exemplo , a produção de carbonato/bicarbonato de sódio é quase integralmente feita pelo método Solvay. Ainda em outros países , o processo Solvay vem sendo substituído por outros e vem caindo em declínio. No Reino Unido por exemplo, além da produção pelo método Solvay, parte do carbonato é feita usando-se uma modificação na fabricação de soda cáustica (pela eletrólise do NaCl), simplesmente fornecendo CO2 ao meio:
2 NaOH + CO2  Na2CO3 + H2O [5]
Na2CO3 + H2O [5]
No processo Solvay mencionado anteriormente, as matérias primas são basicamente: carbonato de cálcio ( CaCO3), cloreto de sódio (NaCl) e amônia (NH3). O carbonato de cálcio tem a dupla função de fornecer o CO2 necessário ao processo e fornecer também CaO, que por sua vez serve para "reciclar" a amônia que está na forma de sal NH4Cl, fornecendo portanto o sal cloreto de cálcio (CaCl2). A amônia simplesmente entra junto com a solução saturada de NaCl (salmoura) e o dióxido de carbono reage com essa solução, produzindo hidrogenocarbonato de amônio in situ que por sua vez reage com o NaCl produzindo NaHCO3, que devido a temperatura baixa,precipita e é separado. Neste processo, no âmbito industrial, o bicarbonato de sódio produzido NÃO é diretamente vendido, por várias razões que serão discutidas mais abaixo. Ele vai para outra secção da planta industrial onde é decomposto em solução, para fornecer o carbonato de sódio (Na2CO3) que é então cristalizado e purificado.
As razões do bicarbonato não ser separado diretamente do processo Solvay para venda são devidas à impurezas presentes no NaHCO3, além da presença de amônia , que além de não tornar ele muito agradável em certas aplicações, ainda faz , lógicamente, o consumo de amônia crescer muito , já que o material deve ser lavado/recristalizado com água. Para produzir bicarbonato outro método é utilizado: Parte do carbonato de sódio produzido no processo Solvay e que se deseja transformar em bicarbonato é dissolvida em água até a saturação, então essa solução resultante passa por colunas de absorção, onde uma corrente ascendente de CO2 se faz passar.. Esse esquema é muito similar à parte do processo da 1ª figura acima, diferindo apenas as etapas subsequentes ( e logicamente , nada de amônia dessa vez). O CO2 reage com a solução e produz o bicarbonato, que , por ser muito menos solúvel que o carbonato, precipita e é então separado por filtros especiais..Essa solubilidade do bicarbonato é ainda menor devido a presença do carbonato. O bicarbonato então pode ser lavado e secado (costumam secar , enquanto transportam , numa correia transportadora, a 60-70°C).
As solubilidades dos compostos puros na água, em função da temperatura , são fornecidas abaixo:
| Temperatura da Solução(°C) | NaHCO3 dissolvido (g) por 100g de água [6],[7] |
| 0 | 6,9 |
| 10 | 8,15 |
| 20 | 9,6 |
| 25 | 10,35 |
| 30 | 11,1 |
| 40 | 12,7 |
| 50 | 14,45 |
| 60 | 16,4 |
| Temperatura da Solução(°C) | Na2CO3 dissolvido (g) por 100g de água [7] |
| 0 | 6,9 |
| 10 | 12 |
| 20 | 21,4 |
| 30 | 39,7 |
| 40 | 48,8 |
| 50 | 47,1 |
| 60 | 45,8 |
| 80 | 44,9 |
| 100 | 44,5 |
A página de uma das referências[6] em que eu encontrei a solubilidade mutual dos dois sais está apresentada abaixo (o tamanho ficou tosco mesmo, mas talvez ficasse pior se estivesse menor, devido a "frágil" escrita do livro):
As principais reações envolvidas na fabricação de carbonato de sódio pelo processo Solvay que eu havia brevemente mencionado antes são portanto:
Pirólise do calcário :
CaCO3(s)  CaO(s) + CO2(g)
CaO(s) + CO2(g)
-----------------------------------
Na coluna de absorção:
NH3(g) + H2O(l)  NH4OH(aq)
NH4OH(aq)
CO2(g) + H2O(l)  H2CO3(aq)
H2CO3(aq)
Portanto:
NH4OH + H2CO3  NH4HCO3 + H2O
NH4HCO3 + H2O
Ou então, escrevendo de um modo mais realístico:
2 NH3(g) + 2 CO2(g) + 2 H2O(l) 2 NH+4(aq) + 2 HCO-3(aq)
2 NH+4(aq) + 2 HCO-3(aq)
Interessantemente , nas reações anteriores e conforme RESULTADOS E DISCUSSÃO de [2], "A reação do CO2 com a solução saturada de NaCl e NH3 são exotérmicas, provocando um aquecimento substancial da solução. Esse aumento de temperatura faz com que a solubilidade dos reagentes gasosos diminua (principalmente NH3), provocando um declínio na eficiência do processo." Portanto , ainda conforme os autores de [2], é necessário bastante refrigeração nessa etapa, para resfriar a solução e com isso obter rendimentos decentes. Nota-se então mais uma possível vantagem do NH4HCO3 no processo de pequena escala amador, porque como o CO2 e o NH3 já estão convenientemente "reagidos" na forma de sal (NH4HCO3), não há mais calor de reação, embora possa ocorrer , de algum modo, algum tipo de "recombinação" dos elementos ao longo do processo Solvay caseiro(em todo caso, mesmo que ocorra , esse fato deve ser praticamente desprezível (pelo menos para nós, amadores)). Também não sei porque esse esquema não é usado no processo Solvay Industrial para evitar esse problema. Muito provavelmente seja devido ao custo do bicarbonato de amônio, comparado com o custo da refrigeração, além de envolver muito menores quantidades de líquido (que acarretam em mais sérios problemas com perda de NaHCO3 por dissolução no excesso de líquido), já que a amônia é feita reagir no mesmo meio que o CO2: a salmoura. Isso então faria precipitar muito mais bicarbonato de sódio.
Enquanto isso, no "seio" da solução...:
NaCl  Na+(aq) + Cl-(aq)
Na+(aq) + Cl-(aq)
Então ocorre isso:
HCO3-(aq) + Na+(aq)  NaHCO3(s)
NaHCO3(s)
(num modo mais simples:
NH4HCO3(aq) + NaCl(aq)  NaHCO3(s) + NH4Cl(aq) )
NaHCO3(s) + NH4Cl(aq) )
Note que "NaHCO3(s)" nas reações não significa que ele é "insolúvel". Significa apenas que a precipitação dele é favorecida nesse ambiente, tanto devido a concentração , quanto devido a presença de outros sais (especialmente o NaCl) e também devido a baixa temperatura da solução. Então o bicarbonato de sódio é filtrado e lavado para remover os sais residuais que ele contém. Então ou é separado ou então vai como solução para outro estágio onde a água da solução é aquecida e é então decomposto para carbonato , de acordo com a seguinte reação:
2 NaHCO3(aq)  Na2CO3(aq) + CO2(g) + H2O
Na2CO3(aq) + CO2(g) + H2O
O NH4Cl formado anteriormente é "reciclado" e transforma-se em amônia e cloreto de cálcio através do óxido de cálcio produzido anteriormente , conforme mais essas resumidas equações:
CaO(aq) + H2O(l)  Ca(OH)2(aq) + Calor
Ca(OH)2(aq) + Calor
2 NH4Cl(aq)+ Ca(OH)2(aq)  2 NH3(g) + 2 H2O + CaCl2(aq)
2 NH3(g) + 2 H2O + CaCl2(aq)
Eu decidi escrever acima que tanto o óxido quanto o hidróxido de cálcio são "solúveis" apesar de essa não ser a verdade : eles tem uma solubilidade ridícula na água(sendo que o CaO reage com ela para formar a segunda substância que tem uma solubilidade em torno de 1-2g/100mL de água e que diminui com o aumento de temperatura, diferente da maioria das substâncias). Mas a razão disso foi devido ao fato de como o NH4Cl(aq) estar presente, ele força a reação com o hidróxido de cálcio, que vai se dissolvendo gradualmente e se transformando em cloreto enquanto a amônia evapora e volta ao processo inicial.
Contudo, no final das contas, se você reparar bem, a equação global gira em torno disso:
CaCO3(s) + 2 NaCl(s)  Na2CO3(aq) + CaCl2(aq)
Na2CO3(aq) + CaCl2(aq)
O que equivale a dizer que por meio da amônia (e do CO2 liberado do calcário) o carbonato de cálcio é feito reagir com o NaCl para produzir , NO FINAL, carbonato de sódio e cloreto de cálcio. Se você bate o olho APENAS nessa simples reação, sem levar em consideração as anteriores, pode achar estranho, porque o carbonato de cálcio é extremamente insolúvel..Isso força a reação para a esquerda.. Em outras palavras: Se você tentar reagir CaCO3 diretamente com NaCl para tentar obter Na2CO3 você NUNCA vai conseguir! Por outro lado , se você fizer duas soluções, uma de CaCl2(aq) e outra de Na2CO3(aq) e as misturar o carbonato de calcio precipita, deixando o NaCl em solução.. Em outras palavras ainda mais diretas: A reação está invertida!!!! 
Por esses pequenos detalhes que eu amo a química..Aparentemente louca e confusa , mas completamente racional e lógica, como não poderia deixar de ser qualquer ciência que se preze.. 


REFERÊNCIAS:
- [1]Baking Soda Could Go Behind the Counter
- [2] Scielo: SIMULAÇÃO DO PROCESSO SOLVAY NO LABORATÓRIO DIDÁTICO
- [3] Inorganic Chemical Preparations - THORP, Frank Hall. - The Athnaeum Press, 1896. - Pag. 187
- [4] "Aplicação"
- [5] Modern Inorganic Chemistry - An Intermediate Text - C. CHAMBERS, A. K. HOLLIDAY, - Butterworth & Co (Publishers) Ltd 1975. - Pag. 133
- [6] Solubilities of Inorganic and Organic Compounds - Atherton Seidell - D. Van Nostrand Company , Inc. - 2ªEd(2ª tiragem)(1919)
- [7] Frogfot's Page(em "Useful Tables" --> "Sodium Salts" e "Potassium Salts")
ATENÇÃO:
Essa página e suas páginas derivadas contém informações que podem ser perigosas. Além disso eu não garanto a total acuracidade ou precisão das referidas informações contidas nelas. As informações contidas em todas as páginas e sub-páginas derivadas e interconectadas dessa página são de caráter genuína e puramente educacional. Eu NÃO me responsabilizo por nenhum dano e/ou fatalidade a indivíduos, ou dano a propriedade decorrente do mal uso das informações aqui contidas, pelo fato de as informações aqui contidas serem de caráter puramente educacional. Basta um mínimo de raciocínio lógico para compreender : NÃO é justo que eu e outros eventuais colaboradores dessa página e de suas subseqüentes ,assim como qualquer outro autor normal, tenha algum tipo de responsabilidade por qualquer acidente que alguém sofra por realizar (ou tentar realizar) qualquer um dos experimentos descritos. Isso é facilmente explicado pelo fato de que eu não ordenei ninguém que fizesse nada descrito aqui e muito menos tenho a capacidade "divina" de ler e ver a mente e a vida de todas as pessoas para saber o que estão fazendo. Portanto, em toda e qualquer hipótese, eu NÃO admito ter o mínimo de responsabilidade , de qualquer ato praticado por qualquer pessoa antes e/ou durante e/ou depois de ler , parcialmente ou totalmente, qualquer uma de minhas páginas.
INÍCIO |
======================================
======================================
======================================
DIGA NÃO A CENSURA NA INTERNET!
SEJA CONTRA O "PROJETO" DO SR. EDUARDO AZEREDO QUE VAI RIDIDULARIZAR A NOSSA INTERNET E RESTRINGIR E FERIR AINDA MAIS NOSSA (JÁ DÉBIL) LIBERDADE, ASSIM COMO NOSSOS DIREITOS!
PRA RIR OU CHORAR?