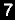Acetona
INTRODUÇÃO:
Claramente, uma das substâncias mais úteis no mundo da química, tanto profissional quanto amadora e que é útil tanto em outras sínteses quanto como solvente para reações e para purificação de outras substâncias, sendo especialmente usada nessa ultima aplicação, tanto na indústria quanto no mundo da química artesanal. No mundo da pirotecnia amadora por exemplo, pode-se fazer um excelente verniz de nitrocelulose usando-se bolinhas de pingue-pongue (obviamente, somente as bolinhas feitas com nitrocelulose funcionam) cortadas em pequenos pedaços e então dissolvidas em acetona.
Infelizmente, no Brasil a acetona pura é relativamente cara (ao menos nas lojas de produtos químicos que eu vi..Onde só havia P.A., Pureza Analítica) além de ser extremamente difícil de encontrar fora das lojas de produtos químicos e ainda por cima, se tornou controlada, devido ao mau uso por alguns retardados que a usam com finalidades ilícitas ; o que acaba tornando cada vez mais difícil para quem quer praticar a VERDADEIRA química artesanal, saudável e instrutiva. Curiosamente, relatos de muitas pessoas em outros países, notadamente nos EUA ou em países europeus (basta ir em qualquer fórum de química estrangeiro para comprovar isso) dão a entender claramente que a acetona lá é extremamente barata e muito pura, sendo vendida nos depósitos de material de construção(e muitos outros lugares), praticamente pura para uso amador.
Tenho certeza de que só esse fato é bem irritante para qualquer químico amador daqui, visto que é muito provável de que os que realmente fazem coisas ilícitas devam obter a sua acetona por meios igualmente escusos..Ou seja, o controle da venda deve afetar muito mais quem faz química caseira 'legal' (como estudantes , hobbistas, etc) do que os que usam para fins ilícitos, porquê com as restrições, o preço que já é caro, se torna praticamente abusivo.
Portanto devido ao motivo da dificuldade em se encontrar acetona relativamente pura e pelo seu preço, essa página foi criada. Outro motivo é estudar e apresentar outros métodos mais acadêmicos, como por exemplo a destilação destrutiva (pirólise) de acetato de cálcio, que embora não possam ter uso prático para o amador no momento, possam ter sim importância, talvez, um uso no futuro. Além disso, como eu sempre penso, é muito mais divertido , inspirador e educativo fazer seus próprios reagentes do que comprar pronto (apesar de quase sempre sair mais caro, sem contar a trabalheira que dá). 


Clique nas figuras acima, caso você não saiba do que se trata.
| Substância , Nome "Popular", Fórmula e Estado Físico Em Que é Comumente Encontrada | Peso Molecular Aproximado | Informações Adicionais |
| Propanona ("Dimetil-cetona" , "Acetona" - CH3COCH3(l)) |
58,078 | A única forma disponível de acetona para ser comprada pela pessoa comum é a forma mais ordinária de "removedor de esmaltes", encontrado em qualquer loja de cosméticos ou mesmo supermercado e que pode conter, no máximo, 60% em acetona (a Polícia Federal restringe a venda de produtos com maiores concentrações) e o resto em uma mistura que pode conter um ou mais das seguintes substâncias, em proporções que podem variar para diferentes marcas: água, etanol, óleo de rícino, corantes, etc. Fique de olho no rótulo e na composição, pois alguns removedores de esmalte podem não ter acetona como constituinte principal ou mesmo nem ter acetona; eu por exemplo já vi numa ocasião um removedor de esmaltes (mais caro) onde se lia "acetato de etila" no rótulo. Eu costumo comprar a "acetona blue", pois apesar de colorida, contém 60% de acetona e especialmente é a mais barata na minha região (e aparentemente contém pouca ou nenhuma água). Geralmente eu compro em recipientes maiores (de 500mL, por exemplo) e em lojas atacadistas, pois sai ainda mais barato. Eu já vi também numa loja especializada em peças para relógios vender VIDROS de 0,5 e 1 litro de acetona, que pareciam conter acetona bem pura (sim, era acetona MESMO, explícito no rótulo, não outro solvente). Infelizmente, esse tipo de situação é daquelas bem raras e duvido muito que qualquer um em quaquer lugar consiga encontrar fácil uma loja do tipo que venda. Informação de Segurança (Inglês) - (Português). |
| Cloreto de Cálcio Anidro ("Anti-Mofo" - CaCl2(s)) |
110,98 | O cloreto de cálcio anidro pode ser comprado na forma de pequenos grânulos em qualquer supermercado decente como "antimofo" e que geralmente vem em um recipiente com dois níveis: no de cima ficam os granulos de CaCl2 e abaixo um nível vazio, para armazenar a água absorvida do ar pelo cloreto. Evite, se puder, as marcas com o cloreto de cálcio colorido e/ou aromatizado; compre o produto branco e inodoro. Também pode ser feito apartir de ácido muriático (HCl) e cal extinta (Ca(OH)2) mas é muito mais trabalho, pois você deverá evaporar toda a água e ainda eliminar a água do cristal (tornando-o anidro). Informação de segurança para o sal anidro (inglês) , para o sal dihidratado (inglês) e para o hexahidratado (inglês) - (Português) |
| Carbonato de Cálcio ( "Calcário" (não é o "calcário dolomítico" vendido nas lojas de adubo) - CaCO3(s)) - |
100,1 | Pode ser usado no lugar do hidróxido de cálcio (cal) para fazer o acetato de cálcio usado no experimento. Uma das boas fontes de carbonato de cálcio é o CaCO3 subproduto da síntese de sulfato de sódio, que está descrita "formalmente" AQUI. Uma outra fonte de carbonato de cálcio é a casca de ovos que contém usualmente 95% de carbonato de cálcio, sendo o resto proteínas e outras porcarias em menor quantidade. O carbonato de cálcio usado no experimento foi derivado de um medicamento (com data de validade vencida) chamado "Ossotrat" ou algo similar que continha carbonato de cálcio na composição. - Informações de segurança (Inglês) |
| Ácido Acético (Ácido Etanóico) ("Vinagre" na sua forma diluída 3-6% - CH3COOH(aq) |
60,05 | O ácido acético aqui usado na síntese do acetato é o simples vinagre. Mas que com muito mais vantagem poderia ter sido substituído por acído acético mais concentrado ou mesmo o "glacial", se eu tivesse.. O vinagre, mesmo o 'branco', é cheio de pequenas quantidades de impurezas (ácido cítrico, ácido tartárico, aldeídos, álcoois como etanol e mesmo metanol , óleos etc) que podem dar cor ao produto final. Portanto comprar vinagre 'colorido' só pioraria a situação. O melhor vinagre para finalidades de química amadora é o branco e o da marca mais barata, com a menor quantidade possível de aditivos de qualquer espécie. Pode-se facilmente notar que nem o vinagre escapou da "maquiagem": antes ele vinha em recipientes de 1000mL e agora em recipientes de 750mL e pelo mesmo preço. Uma vergonha. Informação de segurança: (Inglês), (Português), (Português - Ac. Glacial) |
DESTILAÇÃO DESTRUTIVA (PIRÓLISE) DE ACETATO DE CÁLCIO
Certamente foi uma experiência bem divertida de se fazer e que era na prática realizada numa escala industrial a vários anos atrás, sendo um método mais que centenário. Na realidade, foi um dos primeiros métodos industriais de se fazer acetona e bem antes de outros muito mais rentáveis e menos "sujos" como o método da desidrogenação catalítica do isopropanol e também como valioso subproduto da produção de fenol via oxidação do cumeno.
O método em questão é simples e o seu funcionamento pode ser usado inclusive na preparação de várias outras substâncias, especialmente cetonas e aldeídos. Esse método foi descoberto por Heinrich Limprich e Rafaele Piria , mais ou menos na metade do século XIX , tendo por isso também o nome de "método de Piria" para produção de cetonas.
Nesse método o Ca+2 funciona mais ou menos como o catalizador ativo, visto que não é decomposto de nenhuma forma ; por isso o mais usado eram sais de ácidos carboxílicos (acetato, formato, benzoato, etc) de cálcio. Contudo, em teoria qualquer outro metal alcalino-terroso funciona praticamente igual ao cálcio e portanto os mesmos tipos de sais de bário (Ba+2 eram usados em certas ocasiões).
Esses sais eram simplesmente secos e postos em retortas, as quais eram aquecidas fortemente para se efetuar a pirólise do material, que destilava e era condensado para ser recolhido; depois disso o líquido destilado, que é uma mistura de água, cetonas, aldeídos e outras substâncias era redestilado e opcionalmente purificado de outro modo até o produto desejado ficar numa pureza suficiente.
O engraçado é que a maioria desses sais precursores (especialmente os acetatos) eram feitos apartir de uma outra destilação destrutiva: a da madeira. "Destilando" a madeira se obtinha principalmente o chamado "ácido pirolenhoso" que nada mais era do que uma mistura de água, ácido acético, e pequenas quantidades de várias outras substâncias, incluindo um pouco de acetona. O ácido então era neutralizado com uma substância adequada (Ca(OH)2, CaCO3,etc) a solução era evaporada e então o sal obtido era seco e pirolisado para dar acetona. Nessa síntese existem tantos passos para se chegar na acetona e tão ineficiente, economicamente falando, que logo que outros métodos melhores surgiram, esse método foi abandonado prontamente pela indústria.
Abaixo uma figurinha tosca esquemática (mas praticamente auto-explicativa) do que é acreditado de ocorrer nesse método:
No bom e velho Frogfot[3] é mostrado um experimento detalhado com essa síntese de acetona. Lá ele usa um pequeno aparato feito de metal para reproduzir o experimento.
O objeto da invenção de velha patente inglesa[4], contudo, é exatamente usar um material refratário (cerâmica/concreto) na retorta, pois é dito que a acetona "nascente" ao entrar em contato com o metal faz o rendimento final ser menor. Contudo, não fala o porquê. Possivelmente a acetona seja pirolisada em cetena em contato com o metal quente e outros produtos ainda mais obscuros (e derivados da cetena também se formem, quem sabe..(?)), mas não posso afirmar nada do assunto.. Achar referências sobre o assunto não é tarefa fácil. As informações mais detalhadas que eu consegui são fornecidas num link postado num tópico do SMDB[2], além de uma preparação "curta" no livro do Norris[7].
Possivelmente, em pequena escala, que é como nós amadores estamos acostumados, esse detalhe de usar metal não importasse tanto, então, duvido que deva fazer tanta diferença assim entre usar metal ou cerâmica..Me parece inclusive muito mais fácil e prático usar metal..Quando eu fiz a pirólise (abaixo) eu nem sabia dessa patente supramencionada e muito menos esse fato do metal ser ruim para essa reação, descrito na patente (apesar disso, já sabia que é costume usar metais bem quentes para pirolisar a acetona em cetena , como é descrito não só em bons livros mas inclusive em muitos "manuais" por ai).
EXPERIMENTAL:
Essa 1ª parte tem muito tempo, mas eu ainda me lembro: 1 Litro de vinagre comum com "4% de acidez" (ainda nem tinham 'maquiado' o vinagre ahah..Como eu já disse antes, hoje em dia se você reparar bem só vendem recipientes de 750mL ao invés de 1 litro, e pelo mesmo preço!) foi posto num recipiente de plastico de 3 litros e lentamente foi adicionado CaCO3 (tinha obtido apartir de um remédio velho (vencido), chamado "Ossotran" que é basicamente CaCO3 na forma de pastilha), e agitando o liquido com uma colher, para os comprimidos reagirem mais facilmente e irem se dissolvendo. A quantidade que eu pus foi tal que parte ficou sem se dissolver no vinagre, o que indicou que o ácido foi praticamente neutralizado. Deixei mais algumas horas e então filtrei usando dois filtros de papel (de coar café).
Deixei evaporando ao ar livre, em dois recipentes com uma área grande, no porão (esses 'potes' quadrados/retangulares e rasos de plástico que você acha nas lojas de R$1.99).
Esqueci eles lá e nem lembro de quando voltei para pegar os resíduos deixados nos recipientes (deve ter se passado uns 2 meses quando eu lembrei.. Não queria gastar energia simplesmente para evaporar 1 litro de água e obter uma micharia de quantidade de acetato de cálcio). A crosta de resíduo deixado nos recipientes, era o acetato de cálcio extremamente impuro (com fungos, poeira, etc). O peso total foi de 30-35g (monohidratado - Ca(CH3COO)2*H2O). Mas, e daí? =] Pretendia usá-lo apenas para obter acetona ou quiçá usar um ácido qualquer (H2SO4 preferencialmente) para fazer ácido acético mais concentrado, ou seja, a pureza não era assim tão importante.. Mais um motivo para eu ter deixado a solução evaporar naturalmente 
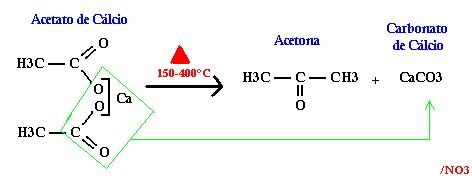
Muito tempo se passou desde então, quando eu finalmente decidi tentar o procedimento de Piria. Como se poderia esperar, todos os recursos foram altamente improvisados  . Usei uma lata de leite ninho (dessas mais antigas que vem com tampa de metal) como recipiente da pirólise e na tampa foi feito um furo por onde passei um "T" de bronze (desses de adaptação de encanamento) e por esse um tubo flexível de cobre. Todas as brechas e interstícios foram então tapados com gesso (exceto a junção lata/tampa..Pois nesse caso, obviamente, seria um bocado difícil remover a tampa da lata). Achei que o gesso talvez não suportasse a temperatura, mas não foi o que aconteceu. Aliás, a temperatura na área da tampa devia ser relativamente baixa, até porque eu usei um 'queimador' improvisado de etanol combustível (posto de gasolina).
. Usei uma lata de leite ninho (dessas mais antigas que vem com tampa de metal) como recipiente da pirólise e na tampa foi feito um furo por onde passei um "T" de bronze (desses de adaptação de encanamento) e por esse um tubo flexível de cobre. Todas as brechas e interstícios foram então tapados com gesso (exceto a junção lata/tampa..Pois nesse caso, obviamente, seria um bocado difícil remover a tampa da lata). Achei que o gesso talvez não suportasse a temperatura, mas não foi o que aconteceu. Aliás, a temperatura na área da tampa devia ser relativamente baixa, até porque eu usei um 'queimador' improvisado de etanol combustível (posto de gasolina).
Na extremidade livre do tubo de cobre eu adaptei o tubo de teflon que faz parte do meu destilador improvisado. O "corpo" do destilador foi feito apartir de uma lampada fluorescente queimada, que teve as extremidades cortadas com muito cuidado e o interior (material fluorescente) limpo. Ficou um tubo jóia; Seria muito mais fácil e especialmente seguro se eu tivesse usado um cano de PVC no lugar.. ehehe mas eu queria na verdade ao menos o mínimo de semelhança com o aparato "profissional". Ficou 10. O tubo que passa por dentro dele é de um fluoropolímero (possivelmente teflon), MUITO resistente a ataques químicos. Se conseguir obter outro material que seja bem suficiente, como PEAD por exemplo, você pode usar sem muito problema. Possivelmente até essas mangueiras de "gasolina" sirvam. Só olhe se é resistente a acetona (tente testar, pra ver se a acetona (preferencialmente quente) ataca um pedaço do tubo). As vedações entre os tubos foram feitas com fita veda-rosca (PTFE). Eu usei como suporte do destilador restos de isopor que iriam pro lixo (era de um microondas. Colei as duas metades e ficou quase uma 'caixa' =] ). Serviu bem. Não tenho câmera no momento, mas vai abaixo, por hora, um desenho esquemático do que se parece.
UPDATE: fotos do destilador usado:


A primeira operação durou no máximo uns 30-40 minutos.. Depois que o fogo do etanol se extinguiu, aproveitei para abrir a lata da pirólise e remecher o resíduo (que ficou cinza/negro) e reesquentar. Mas não veio quase nada destilando dessa vez, então após 10 minutos de aquecimento, dei a operação por finalizada.
O gasto de água de resfriamento (do condensador) foi incrivelmente baixo, todo esse tempo e apenas 1 mero balde de água(que depois foi jogada nas plantas, para não se desperidçar nada =]), porque com a pequena quantidade de destilado, o condensador não esquentava muito, especialmente a água do condensador, que sempre estava fria, ou seja, bastou um fluxo de água de algumas gotas por segundo  .
.
O "rendimento" foi meros 3,1mL de um líquido marrom claro que tinha acetona, água (principalmente) e outros produtos com cheiros muito mais fortes e repugnantes... A maior parte da água é muito provável de ser exclusivamente devido a eu ter usado o acetato monohidratado sem antes tentar tornar anidro (na verdade, nem me importei com isso..A quantidade era pequena mesmo). Aquela merda que destilou fede tanto que é quase certo de que eu nunca mais vou realizar essa experiência.. Até hoje o meu destilador fede esse cheiro nauseante e apesar do tubo de destilação ser feito apartir de um fluoropolímero, na parte anterior o liquido (quente obviamente) deixou uma leve marca  .
.
Não tentei redestilar ou purificar nada, pelo mesmo motivo: quantidade extremamente pequena. No final eu joguei o liquido no chão (cimento) e simplesmente queimei tudo 

 . Não iria guardar uma quantidade tão pequena de líquido, ainda mais com aquele cheiro. Enquanto o liquido estava no chão observei uma coisa engraçada, que se formavam pequenas bolhas.. Isso é forte indício de que havia um pouco de ácido acético (e provavelmente menores quantidades de outros ácidos) no destilado.
. Não iria guardar uma quantidade tão pequena de líquido, ainda mais com aquele cheiro. Enquanto o liquido estava no chão observei uma coisa engraçada, que se formavam pequenas bolhas.. Isso é forte indício de que havia um pouco de ácido acético (e provavelmente menores quantidades de outros ácidos) no destilado.
DESTILAÇÃO DE REMOVEDOR DE ESMALTE
Certamente o método mais "clean" e mais cômodo de todos (bom, ao menos enquanto houver removedores de esmalte a base de acetona.. Provavelmente algum dia mudem para outras substâncias, ai o amador vai ter que quebrar a cuca se quiser obter acetona artesanalmente).
BREVE DESCRIÇÃO:
O mesmo destilador do método anterior foi usado (imagem acima) durante todo o processo, exceto que algumas modificações se tornaram necessárias, como por exemplo, substituir a lata de pirólise por um recipiente de vidro (usei uma garrafa de vidro de coca cola 1,25L ; na tampa da garrafa foi feito um ligeiro buraco por onde passaria o tubo "teflon" com fita teflon (pra vedar bem). Essa garrafa foi então posta numa lata 'nescau' grande com água e uma pedra no fundo para agir como um banho maria improvisado) e o gasto de água de resfriamento, como já previsto, foi MUITO maior que o da destilação 'a seco' do acetato de cálcio, foram gastos uns 6-7 baldes ao todo (a água foi aproveitada depois para irrigar as plantas e árvores. Desperdício ZERO  ). Pus 500mL de "acetona blue 60%" na garrafa e após alguns minutos de aquecimento no banho maria, o líquido começou a ferver dentro da garrafa. Liguei a água da torneira e ajustei de tal maneira que caia um fluxo mais ou menos constante de várias gotas dentro do balde (formando quase um filete fino de água) que enchia o balde relativamente rapido ; para regular basta pôr a mão no destilador na parte onde sai a água, se houver algum ponto quente, significa que o calor do destilado está passando para a água de resfriamento mas que esta é insuficiente; portanto o fluxo de água precisa ser aumentado mais um pouco, até que não sinta quente (significa que grande parte do vapor de acetona se condensou nas paredes do tubo de teflon dentro do corpo do destilador). Após alguns minutos um líquido INCOLOR
). Pus 500mL de "acetona blue 60%" na garrafa e após alguns minutos de aquecimento no banho maria, o líquido começou a ferver dentro da garrafa. Liguei a água da torneira e ajustei de tal maneira que caia um fluxo mais ou menos constante de várias gotas dentro do balde (formando quase um filete fino de água) que enchia o balde relativamente rapido ; para regular basta pôr a mão no destilador na parte onde sai a água, se houver algum ponto quente, significa que o calor do destilado está passando para a água de resfriamento mas que esta é insuficiente; portanto o fluxo de água precisa ser aumentado mais um pouco, até que não sinta quente (significa que grande parte do vapor de acetona se condensou nas paredes do tubo de teflon dentro do corpo do destilador). Após alguns minutos um líquido INCOLOR  resultou no recipiente coletor (outra garrafa de vinho dentro de um banho de água e gelo, igual na figura acima). Não destilei tudo; parei quando restou mais ou menos 1/3-1/4 do volume original da acetona na garrafa de destilação (coca-cola), que provavelmente era em maior parte etanol, corantes, etc (e o resto da acetona que não destilou). Peguei esse "resto" e usei depois no queimador de etanol (fonte de aquecimento), para destilar mais 250ml de acetona blue "fresca", repetindo o processo já dito. No total, juntando as duas frações destiladas foram obtidos ~530mL de um líquido incolor, com um cheiro maio ruim (por causa do cheiro da destilação anterior do acetato, tão forte e impregnante que acabou 'contaminando' o cheiro da acetona também.
resultou no recipiente coletor (outra garrafa de vinho dentro de um banho de água e gelo, igual na figura acima). Não destilei tudo; parei quando restou mais ou menos 1/3-1/4 do volume original da acetona na garrafa de destilação (coca-cola), que provavelmente era em maior parte etanol, corantes, etc (e o resto da acetona que não destilou). Peguei esse "resto" e usei depois no queimador de etanol (fonte de aquecimento), para destilar mais 250ml de acetona blue "fresca", repetindo o processo já dito. No total, juntando as duas frações destiladas foram obtidos ~530mL de um líquido incolor, com um cheiro maio ruim (por causa do cheiro da destilação anterior do acetato, tão forte e impregnante que acabou 'contaminando' o cheiro da acetona também.  Mas isso não faz praticamente nenhuma diferença além do cheiro pois as propriedades continuam as mesmas).
Mas isso não faz praticamente nenhuma diferença além do cheiro pois as propriedades continuam as mesmas).
A acetona destilada foi então posta em uma garrafa PET 1.5L incolor, devidamente rotulada e então fechada e armazenada num local seguro (local fresco, seco e escuro, longe de crianças, animais e especialmente faíscas e qualquer coisa que possa lembrar fogo ou aquecimento).
O recipiente em plástico PET parece bem resistente e satisfatório para guardar a acetona e provavelmente muitas de suas soluções (para guardar o verniz de nitrato de celulose, por exemplo, é uma maravilha) , apesar de que notei que o local próximo do gargalo, assim como o fundo (partes onde a camada de plástico PET é mais grossa) ficaram esbranquiçados. Mas *aparentemente* nada mais mudou com o recipiente e ele *aparenta* ser forte e resistente como antes. Eu poderia ter usado vidro, mas além do vidro ser frágil a queda, também é mais útil para guardar outras substâncias geralmente mais 'agressivas' a plásticos.
NOTE que o líquido obtido no procedimento não é "100% acetona". Ele provavelmente contém ainda bastante etanol e provavelmente até um pouquinho de água e outras porcarias também, mas certamente tem todas essas impurezas em bem menos quantidade do que o produto original do supermercado. É um bocado difícil separar completamente o etanol da acetona simplesmente porque os pontos de ebulição(PE) das duas substâncias serem relativamente próximos (ESQUEÇA o que os seu livro de 8ª série diz a respeito "numa mistura a substância de menor PE entra em ebulição, vaporiza e então a outra substância de PE maior entra em ebulição..."..História "pra boi dormir" ahahahah) ; isto significa que na realidade as duas substâncias entram em ebulição ao mesmo tempo, possivelmente formando um quase um azeótropo, mas com uma porcentagem maior de acetona destilando nessa mistura, pois a pressão de vapor da acetona é menor do que a do etanol e bem menor que o da água. Mesmo com colunas de destilação (Vigreux, etc), pode ser um bocado difícil separar o etanol da acetona.
Existe contudo um simples "truque" que eu poderia usar para remover o etanol e a água ao mesmo tempo que é simplesmente adicionar bastante cloreto de cálcio anidro na mistura destilada (na temperatura ambiente) e deixar por alguns dias, mexendo ocasionalmente. O cloreto de cálcio forma complexos sólidos com álcoois primários (ex.: etanol), secundários (ex.: isopropanol) e se me lembro bem terciários também. E quanto mais simples o álcool, mais fácil e estável será o complexo (metanol e etanol sendo ótimos exemplos de bons complexos). Também se formam complexos com cetonas (como a acetona) mas estes são tão 'fracos' e instáveis comparando com os dos alcoois que praticamente devem ser desprezíveis. Além disso o cloreto de cálcio também pode contribuir para 'pegar' alguma água que esteja 'dando bobeira' na mistura.
A razão de reagir com alcoois é uma das razões pelas quais o cloreto de cálcio não é recomendado para secá-los.
Apenas para sua melhor informação, esse complexo formado com o etanol é dito de possuir a fórmula CaCl2*4CH3CH2OH (s); infelizmente eu não procurei maiores informações sobre ele. Porém, pouco me importa isso agora, pois a acetona destilada uma vez sem nenhum tipo de tratamento se mostrou bem satisfatória no que eu costumo usar ela (para fazer verniz de nitrato de celulose, com bolinhas de pingue-pongue cortadas e acetona).Além disso, não estou com CaCl2 no momento (gastei o que eu tinha na síntese de cloreto de cobre II, o qual ainda nem extrai os cristais da solução! Oh falta de tempo maldita  )
)
Porém, se precisar de acetona mais pura algum dia, tentarei fazer o procedimento e postarei aqui: como já disse antes, simplesmente misturar uma boa quantidade de CaCl2 anidro no destilado durante alguns dias com agitação ocasional.Daí, basta filtrar a mistura para remover o complexo sólido, espremer bem o filtro para remover o líquido interstícial e re-destilar o líquido filtrado como já descrito. O rendimento 'global' com base no produto original certamente será MUITO menor e o trabalho, custos, gasto de energia e tempo muito maiores, mas sem dúvida dando uma acetona bem mais pura.
Por quê filtrar o complexo para só então destilar o líquido? Por quê não simplesmente destilar o liquido sem remover o complexo? SIMPLES: o complexo se decompõe com o calor, liberando novamente o etanol e o CaCl2,o que significa que de nada adiantou o esforço para separar o etanol da acetona, pois ele está destilando com ela do mesmo modo que sem o cloreto de cálcio. Eu não conheço a temperatura de decomposição desse cloreto, mas suponho que não deve ser alta, pois a maioria dos complexos que o cloreto de calcio forma não costumam ser muito estáveis com a elevação da temperatura.
Se quiser pureza ainda maior (especialmente para se livrar da água), então é recomendado redestilar mais uma vez, mas usando dessa vez outros agentes desidratantes como sulfato de cálcio anidro, sulfato de cobre anidro, etc. Bom, tem muito mais 'segredos' e 'truques' sobre esse procedimento, portanto se for tentar isso algum dia, é recomendável que pesquise...
UPDATE:
RESULTADOS:

(note a diferença. "Antes e Depois")
 (Mais uma vez.. Não ficou tão boa a visualização, mas dá para perceber um pouco a diferença)..
(Mais uma vez.. Não ficou tão boa a visualização, mas dá para perceber um pouco a diferença)..
OUTROS MÉTODOS :
Aqui serão abordados apenas na teoria alguns métodos inusitados, muitos dos quais levantados por amigos sem os quais essa parte não existiria (vide "Agradecimentos Especiais" no final desse artigo). No caso de alguns foi tentado algo por mim, mas sem grandes sucessos.
"REAÇÃO DE NEF"[5],[6] :
Longe de ser um método prático para obter propriamente acetona, me parece apenas uma reação mais "acadêmica".
Conceitualmente a hidrólise ácida de um nitroalcano para um aldeído ou cetona e óxido nitroso[6] (vide imagem abaixo):
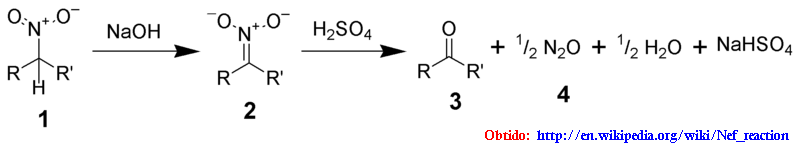
Por essa imagem pode ser visto que a substância que dá acetona como produto nesse tipo de reação é o 2-nitropropano, que é infinitamente mais difícil de fazer/se obter, logo, o ponto todo seria mesmo acadêmico =].
OXIDAÇÃO DO ISOPROPANOL (IPA):
Essa é a síntese mais "manjada" de acetona de todos os livros e links de orgânica, até nos 'piorzinhos' ao menos cita. Em outros livros há a descrição maciça do processo, que é muito usado no Lab quando não há acetona (um bocado difícil de acontecer atualmente, mesmo com todo o 'controle' sobre a acetona). Não vou me ater a esse processo, pois é óbvio que é altamente provável que nenhum químico amador iria desperdiçar dicromato para fazer acetona, a não ser que sua meta fosse o sulfato de cromo III ou então o óxido de cromo III.
Um dos processos industriais costuma fazer uso da oxidação aeróbica do isopropanol (IPA) catalizada por certos metais(como cobre sendo o mais clássico) e outros compostos aquecidos. Neste processo o vapor de IPA junto com uma quantidade definida de ar é passada sobre/dentro do catalizador aquecido. Alguns procedimentos excluem a entrada de oxigênio atmosférico, para tentar evitar a oxidação da acetona formada (apesar de que nesta variação do processo o gasto de energia costuma ser um pouco maior), neste processo o IPA sofre uma desidrogenação que também resulta em acetona (em ambos os casos ocorre uma oxidação do IPA.. ).
OXIDAÇÃO CATALÍTICA DIRETA DO ETANOL[8],[9]:
Esse é um dos métodos mais modernos e curiosamente um dos possivelmente mais aptos para adoção no homelab, pois envolve substâncias de simples aquisição/síntese. O método envolve passar etanol, ar (ou então O2) e vapor dagua sobre um catalizador aquecido composto basicamente de óxido de cálcio e óxido de zinco calcinado...
Não consegui encontrar maiores detalhes sobre a reação e sobre o(s) catalizador(es), aparentemente são conjuntos de reações BEM complexas. Minha teoria, que é bem provável de estar errada, mas que não é descartável, é de toda a seguinte sequência de reações ocorrendo in situ: oxidação do etanol para acetaldeído e oxidação deste para acido acético, reação do ácido com o catalizador e formação de acetato, decomposição do acetato gerando acetona e regenerando o catalizador. Seria praticamente o método de píria ocorrendo de modo contínuo.
Se isso for verdade, então está proposto o melhor método artesanal para obtenção de acetona em grandes quantidades apartir do barato etanol de posto de combustível, alguns metros de tubo de cobre, carvão, catalizador caseiro, ar e.. muita imaginação para improvisação!!! ![]()
![]()
![]()
REFERÊNCIAS:
- [1] SMDB
- [2] SMDB
- [3] Frogfot (Infelizmente, esse link não funcina mais)
- [4] Patente Britânica - GB137558 : Improvements in the manufacture of acetone by the dry distillation of pyrolignite oflime and other acetates
- [5] "Nef Reaction"
- [6] "Nef Reaction"(Wikipedia)
- [7] EXPERIMENTAL ORGANIC CHEMISTRY - James F. Norris - McGRAW-HILL BOOK COMPANY, INC., 1924 (2ª Ed)
- [9] SMDB
ATENÇÃO:
Essa página e suas páginas derivadas contém informações que podem ser perigosas. Além disso eu não garanto a total acuracidade ou precisão das referidas informações contidas nelas. As informações contidas em todas as páginas e sub-páginas derivadas e interconectadas dessa página são de caráter genuína e puramente educacional. Eu NÃO me responsabilizo por nenhum dano e/ou fatalidade a indivíduos, ou dano a propriedade decorrente do mal uso das informações aqui contidas, pelo fato de as informações aqui contidas serem de caráter puramente educacional. Basta um mínimo de raciocínio lógico para compreender : NÃO é justo que eu e outros eventuais colaboradores dessa página e de suas subseqüentes ,assim como qualquer outro autor normal, tenha algum tipo de responsabilidade por qualquer acidente que alguém sofra por realizar (ou tentar realizar) qualquer um dos experimentos descritos. Isso é facilmente explicado pelo fato de que eu não ordenei ninguém que fizesse nada descrito aqui e muito menos tenho a capacidade "divina" de ler e ver a mente e a vida de todas as pessoas para saber o que estão fazendo. Portanto, em toda e qualquer hipótese, eu NÃO admito ter o mínimo de responsabilidade , de qualquer ato praticado por qualquer pessoa antes e/ou durante e/ou depois de ler , parcialmente ou totalmente, qualquer uma de minhas páginas.
INÍCIO |
======================================
======================================
======================================
DIGA NÃO A CENSURA NA INTERNET!
SEJA CONTRA O "PROJETO" DO SR. EDUARDO AZEREDO QUE VAI RIDIDULARIZAR A NOSSA INTERNET E RESTRINGIR E FERIR AINDA MAIS NOSSA (JÁ DÉBIL) LIBERDADE, ASSIM COMO NOSSOS DIREITOS!
PRA RIR OU CHORAR?